Đại dịch COVID-19 đã kết thúc nhưng sự ra đời của vaccine COVID-19 với công nghệ mRNA lại báo hiệu sự khởi đầu của một kỷ nguyên mới trong y học hiện đại. Quy trình phê duyệt đặc biệt cho vaccine mRNA của FDA đã để lại nhiều tác dụng phụ liên quan đến công nghệ mới này. Trong loạt bài sau, chúng tôi làm rõ những lo ngại về vaccine mRNA liên quan đến thành phần nano lipid, protein gai và tình trạng nhiễm bẩn của vaccine dựa trên những tài liệu đã được công bố.
Tóm tắt những điểm chính trong loạt bài này
- Hồ sơ gửi đến Ủy ban Giao dịch Chứng khoán Hoa Kỳ của công ty dược phẩm Moderna vào tháng 6 năm 2020 cho biết: “Hiện tại, vaccine mRNA được Cục Quản lý Thực phẩm và Dược phẩm (FDA) xem là một sản phẩm của liệu pháp gen”.
- Vào tháng 6 năm 2020, FDA đã ban hành một hướng dẫn mới để các sản phẩm của liệu pháp gen như vaccine COVID-19 có thể lưu hành trên thị trường. Những sản phẩm này sẽ không phải trải qua các thử nghiệm giống như các liệu pháp RNA khác. Những loại vaccine mới cũng không bị bắt buộc thực hiện nghiên cứu phân phối sinh học ở người.
- Nếu áp dụng quy trình chuẩn với vaccine mRNA, thì sẽ cần xác định 3 yếu tố sau đây trước khi cho phép sử dụng ở người:
- Lớp vỏ nano lipid dùng để vận chuyển mRNA có thể gây viêm và kết dính nhau hoặc phân rã khiến phân tử mRNA thoát ra ngoài và lưu thông tự do trong máu.
- Những phân tử protein gai do mRNA mã hóa và tiểu đơn vị S1 của phân tử này được tìm thấy trong máu sau khi tiêm vaccine. Cả protein gai và tiểu đơn vị S1 đều có liên quan đến tình trạng viêm và rối loạn đông máu.
- Sự nhiễm bẩn trong quá trình sản xuất có thể tạo nên tạp chất trong vaccine, ví dụ như các mảnh mRNA và plasmid của vi khuẩn. Những thử nghiệm do công ty dược thực hiện trước khi xin phê duyệt cho thấy có tạp chất trong vaccine – liệu rằng vấn đề này đã được khắc phục hay chưa?
- Dù liệu pháp mRNA có rất nhiều tiềm năng, nhưng việc lấy lý do tình trạng khẩn cấp để không tuân thủ quy trình chuẩn liệu có hợp lý không?
- Phải chăng chúng ta chỉ nên khuyến cáo loại vaccine này cho nhóm người có nguy cơ cao nhất và chờ thêm những thử nghiệm khác trên người? Tờ thông tin của vaccine có nên ghi đầy đủ tất cả những nguy cơ có thể để người tiêm được biết?
- Việc thiếu những bước kiểm tra an toàn chuẩn khi phê duyệt có phải là vô đạo đức hay không?
- Tất cả những câu hỏi này đều có liên quan đến quá trình phát triển loại vaccine mRNA mới để chống lại virus hợp bào hô hấp và virus cúm. Khung pháp lý nào sẽ được áp dụng cho những loại vaccine này trong tương lai? Liệu những loại vaccine mRNA mới này có được giám sát chặt chẽ hơn dưới khái niệm “liệu pháp gen” (từ do công ty Moderna sử dụng) hay vẫn sử dụng khung pháp lý dùng cho vaccine COVID-19 mRNA?
Khi phát triển một loại vaccine mới sử dụng cho người thì loại vaccine này phải trải qua một quá trình thử nghiệm rất nghiêm ngặt về độ an toàn – đầu tiên là thử nghiệm trên động vật, sau đó mới được thử nghiệm trên người.
Để minh họa vaccine mRNA, chúng ta hãy hình dung vaccine COVID-19 là một quả trứng biến đổi gen được FDA kiểm tra độ an toàn trước khi sử dụng cho người. “Vỏ” trứng chính là là lớp vỏ nano lipid (LNP) và phần biến đổi gen bên trong là các phân tử mRNA và protein gai.
FDA đã quyết định nới lỏng quy định và chỉ thử nghiệm lớp vỏ LNP trên động vật mà bỏ qua bước thử nghiệm những thành phần bên trong (mRNA và protein gai) trên động vật và cả trên người. Đây là những thử nghiệm kiểm tra phản ứng của cơ thể con người với các sản phẩm của công nghệ mới (nghiên cứu phân phối sinh học).
Nói cách khác, FDA đã phê duyệt những loại “vaccine” mRNA tiêm vào cơ thể người mà không đánh giá sự phân phối sinh học của “các thành phần bên trong” (mRNA và protein gai) nhằm kiểm tra mức độ an toàn với con người. Cơ quan này chỉ kiểm tra “lớp vỏ” LNP trên động vật trước khi phê duyệt. Ngay cả những dữ liệu về thử nghiệm LNP cũng còn hạn chế. Đây là điều rất đáng báo động.
Mặc dù thiếu những thử nghiệm an toàn đầy đủ để sử dụng “vaccine” mRNA cho người, FDA vẫn phê duyệt và đảm bảo với người dân rằng tất cả những thành phần của loại vaccine này đều an toàn. Sau đó, khi những tác dụng phụ nghiêm trọng xuất hiện với tỷ lệ chưa từng thấy, FDA vẫn chỉ đưa ra những tuyên bố về tính an toàn của vaccine chứ không yêu cầu nghiên cứu bổ sung.
Những dữ liệu giới hạn hiện có cũng cho thấy nhiều lo ngại vì theo những dữ liệu này, lớp vỏ LNP sẽ di chuyển khắp cơ thể chứ không phải chỉ tập trung tại một nơi. Các loại thuốc khác chắc chắn sẽ không được phê duyệt nếu chỉ dừng lại ở mức độ thử nghiệm như thế này.
Cơ quan Dược phẩm Châu Âu (EMA), một cơ quan có chức năng tương đương với FDA Hoa Kỳ đã cung cấp nhiều thông tin về vấn đề này. EMA công bố nhiều chi tiết hơn về quá trình lớp vỏ LNP di chuyển khắp cơ thể. Cơ quan này cũng bày tỏ sự lo ngại về các tạp chất trong quá trình sản xuất vaccine. Trong loạt bài này,chúng tôi sẽ thảo luận về các vấn đề trên, trong đó có cả các trích dẫn từ báo cáo của EMA. Trong bài này, chúng tôi sẽ đề cập đến bản báo cáo được công ty Pfizer đệ trình lên FDA. Tuy nhiên bản báo cáo này chỉ được công khai khi có Yêu cầu Tự do Thông tin. Tại sao FDA không sẵn sàng chia sẻ bản báo cáo của Pfizer?
Nới lỏng quy định đối với vaccine COVID mRNA
Trước khi phê duyệt một loại thuốc hoặc một loại vaccine mới, các cơ quan y tế sẽ phải kiểm tra quá trình chuyển hóa thuốc của cơ thể.
Thông thường, công ty dược sẽ phải đệ trình lên FDA các báo cáo nghiên cứu dược động học (PK) phi lâm sàng để giải thích về quá trình giải phóng, hấp thụ, phân phối, chuyển hóa và bài tiết thuốc ra khỏi cơ thể. Đó chính là nghiên cứu phân phối sinh học.
Tuy nhiên, FDA đã sửa đổi quy trình phê duyệt chuẩn đối với vaccine mRNA để đối phó với tình trạng khẩn cấp về sức khỏe cộng đồng trong đại dịch COVID. “Các khuyến nghị không ràng buộc” mới dành cho ngành công nghiệp dược phẩm đã được ban hành vào tháng 6 năm 2020 nhằm nới lỏng các quy định phê duyệt vaccine mRNA so với những yêu cầu cần có của một sản phẩm từ “liệu pháp gen”.
Hướng dẫn mới của FDA cho phép công ty dược có thể sử dụng dữ liệu từ các sản phẩm khác. Nói cách khác, có thể dùng nghiên cứu của những sản phẩm khác để hỗ trợ quá trình phê duyệt vaccine mRNA trong trường hợp khẩn cấp.
“Có thể tăng tốc quá trình phát triển vaccine COVID-19 dựa trên những kiến thức thu được từ các sản phẩm tương tự với cùng công nghệ sản xuất, trong phạm vi cho phép về mặt pháp lý và khoa học”.
“Trong một số trường hợp, có thể không cần thực hiện các nghiên cứu an toàn phi lâm sàng trước khi thử nghiệm lâm sàng lần đầu tiên trên người nếu có thông tin đầy đủ về tính an toàn của sản phẩm từ các nguồn khác. Ví dụ: nếu vaccine COVID-19 mới được tạo ra bằng công nghệ đã được sử dụng để sản xuất loại vaccine được cấp phép trước đó hoặc loại vaccine thử nghiệm đã được nghiên cứu trước đó và có đủ đặc điểm, thì có thể sử dụng những dữ liệu về độc tính (ví dụ: dữ liệu từ các nghiên cứu độc tính với liều tiêm lặp lại, nghiên cứu phân phối sinh học) và dữ liệu lâm sàng của các sản phẩm khác sử dụng cùng một công nghệ để hỗ trợ thử nghiệm lâm sàng lần đầu tiên trên người cho loại vaccine COVID-19 mới”.
Yêu cầu thực hiện nghiên cứu phân phối sinh học được viết bằng những thuật ngữ rất chung chung, không đủ cụ thể với một chế phẩm mới như vaccine COVID-19 mRNA:
“Cần xem xét nghiên cứu phân phối sinh học trên động vật nếu cấu trúc vaccine có bản chất mới và không có dữ liệu phân phối sinh học của công nghệ được sử dụng để sản xuất vaccine. Cần thực hiện những nghiên cứu này nếu có khả năng thay đổi khả năng lây nhiễm và tính hướng mô hoặc khi vaccine được sử dụng ở một đường dùng hoặc một dạng công thức mới”.
FDA đã nới lỏng quy định để phê duyệt các sản phẩm vaccine mới, nhưng nhiều nhà khoa học cho rằng cần kiểm tra cụ thể hơn. Ví dụ, một báo cáo của Vervaeke và các đồng nghiệp cho biết: “Sự gia tăng nhanh chóng các phương pháp trị liệu mRNA khiến khung pháp lý không đáp ứng kịp”. Trong phần tóm tắt, nhóm tác giả cho rằng nên sử dụng “cách tiếp cận nhiều lớp” để hiểu tác dụng của chế phẩm mới trong môi trường in vivo (cơ thể người). Một giải pháp cụ thể được các tác giả đề xuất nêu rõ: “Các nghiên cứu phân phối sinh học cho liệu pháp RNA nên bao gồm cả các phân tử RNA, các thành phần của chất mang, các loại thuốc dùng chất mang RNA và sản phẩm protein được tạo ra”.
Nói cách khác, chúng ta phải kiểm tra cả vỏ trứng và những thành phần bên trong. Việc tuân thủ các hướng dẫn này rất quan trọng trước khi cho phép sử dụng ở con người. Tuy nhiên, theo chúng tôi được biết, chưa có loại vaccine mRNA COVID-19 nào từng được nghiên cứu phân phối sinh học để đánh giá phân tử RNA và phân tử protein gai do RNA mã hóa. Chỉ có lớp vỏ nano lipid được tiến hành nghiên cứu phân bố sinh học, tuy nhiên nghiên cứu này cũng chỉ thực hiện trên động vật chứ chưa nghiên cứu trên người.
Đánh giá của FDA về nghiên cứu phân phối Sinh học của Pfizer
Dựa trên những quy định đã được sửa đổi với vaccine mRNA, FDA đã đánh giá báo cáo nghiên cứu phân phối sinh học với chất mang BNT162b2 LNP của Pfizer vào tháng 11 năm 2020 để xác định phương thức hoạt động của vaccine mRNA. Báo cáo này được đánh dấu là “đã phê duyệt” vào ngày 9 tháng 11 năm 2020 (pdf).
Báo cáo này cũng đã được nhiều tổ chức như Cơ quan Dược phẩm Châu Âu, Hiệp hội Sản phẩm Trị liệu Úc và chính phủ Nhật Bản chấp nhận.
Tuy nhiên, lớp vỏ LNP chỉ là chất mang của vaccine mRNA (“vỏ” của “quả trứng”); LNP không phải là thành phần hoạt chất chính của vaccine mRNA (thành phần bên trong của “quả trứng”).
Hơn nữa, phần bên trong của quả trứng cũng được thay thế bằng một chất khác – phân tử mARN trong nghiên cứu về LNP mã hóa cho (luciferase), chứ không phải phân tử mRNA mã hóa cho protein gai trong vaccine. Đồng thời, hai trong số các loại lipid được sử dụng trong phân tử LNP chưa từng được cho phép sử dụng ở người trước đây. Như vậy, những phân tử lipid mới được sử dụng làm chất mang cho một loại vaccine mới để tiêm chủng hàng loạt, nhưng lại không có nghiên cứu phân phối sinh học của những thành phần này.
FDA thường yêu cầu các nghiên cứu trên người trong quá trình phát triển thuốc và chỉ cần nghiên cứu trên sáu tình nguyện viên khỏe mạnh là đủ. Nếu biết rằng cơ thể sẽ sản xuất protein gai sau khi tiêm vaccine, lẽ ra chúng ta phải thực hiện các nghiên cứu để đánh giá quá trình sản xuất, phân phối và chuyển hóa mRNA và protein gai trên khắp cơ thể.
Mặc dù không hoàn toàn lý tưởng, nhưng các nghiên cứu trên động vật cũng có thể tiết lộ nhiều thông tin hữu ích. Nghiên cứu phân phối sinh học do Pfizer đệ trình lên FDA đã sử dụng cách đánh dấu phóng xạ các phân tử LNP trong vaccine và tiêm cho 21 con chuột đực và 21 con chuột cái. Điều này cho phép các nhà khoa học theo dõi và định lượng lượng vaccine đến các cơ quan khác nhau trong vòng 48 giờ sau tiêm.
Những con chuột được tiêm 50 microgam vaccine mRNA. Sau 15 phút, ngoài việc có nồng độ mRNA tương đối cao tại vị trí tiêm, vaccine bắt đầu phân tán đến nhiều cơ quan khác nhau trên khắp cơ thể, trong đó đầu tiên là đến gan và lách.
Sau một giờ, nồng độ của vaccine trong gan và lách tăng lên và đồng thời vaccine cũng đến tuyến thượng thận và tủy xương.
Sau 24 giờ, các nhà nghiên cứu kiểm tra sự phân phối của vaccine mRNA ở chuột và phát hiện rằng ngoài nồng độ cao nhất ở vị trí tiêm, nồng độ vaccine tập trung cao lần lượt theo thứ tự là lách, gan, tuyến thượng thận, buồng trứng, tủy xương, hạch bạch huyết, thận, cơ và tim. Bạn hãy tìm con số 24.288 với nồng độ ở gan sau 48 giờ. Con số này cũng xuất hiện trong các báo cáo của Úc và Nhật Bản được đề cập đến trong phần 2 của loạt bài này.
Hình 1: Dữ liệu về sự phân phối sinh học trên chuột trong báo cáo của FDA
-
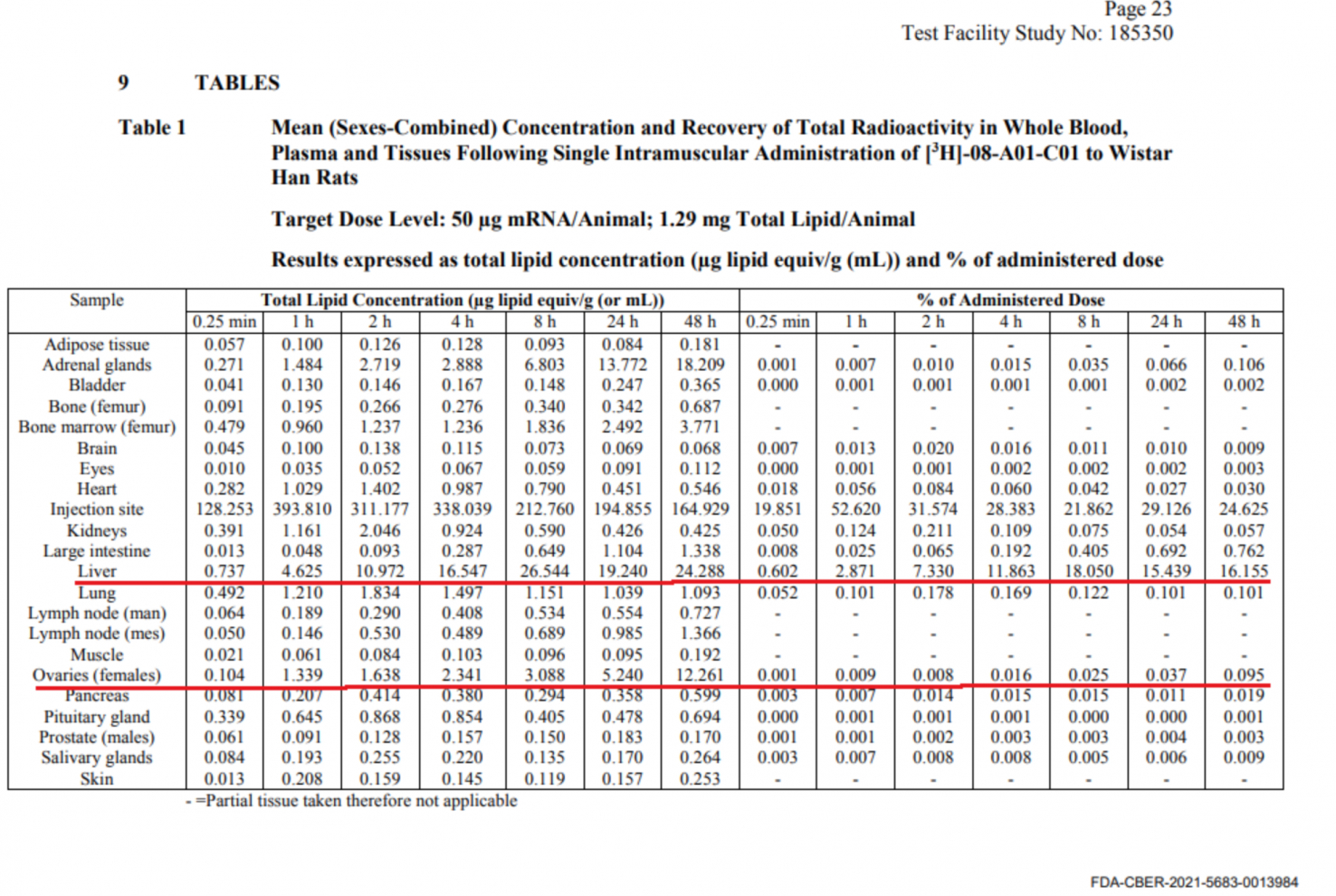
- Dữ liệu về sự phân phối sinh học trên chuột trong báo cáo của FDA, tháng 11 năm 2020. (Nguồn: FDA-CBER-2021-5683-0013976)
Thông điệp trấn an của CDC bị xóa bỏ trong im lặng
Sau khi vaccine được cấp phép, Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ (CDC) đã tìm cách xoa dịu những lo ngại về độc tính của vaccine và tuyên bố rằng phân tử mRNA sẽ bị phân giải và nhanh chóng đào thải ra khỏi cơ thể, đồng thời protein gai sẽ cần nhiều thời gian hơn để đào thải. (Hình 2a)
Tuyên bố này được đăng trên trang web của CDC vào ngày 15 tháng 7 năm 2022, nhưng sau đó đã bị xóa bỏ một cách lặng lẽ. Phải chăng hành động này cho thấy CDC thừa nhận rằng thiếu bằng chứng để đưa ra tuyên bố trên?
Hình 2a: CDC đảm bảo rằng phân tử mRNA và protein gai sẽ bị phân giải nhanh chóng
-

- CDC đưa ra lời đảm bảo rằng mRNA và protein tăng đột biến sẽ phân hủy nhanh chóng trong cơ thể vào ngày 15 tháng 7 năm 2022. (Nguồn: kho lưu trữ web cdc.gov )
Sau tháng 7 năm 2022, CDC đã cập nhật nội dung trên trang web này để trấn an công chúng rằng vaccine mRNA không tích hợp vào bộ gen người, nhưng không đề cập đến việc protein gai và mRNA sẽ tồn tại bao lâu trong cơ thể. (Hình 2b)
Hình 2b: CDC cam đoan rằng mRNA không xâm nhập vào nhân tế bào
Tại sao CDC thay đổi tuyên bố trên trang web của mình và nhấn mạnh vào sự tích hợp vào DNA của mRNA thay vì thời gian tồn tại trong cơ thể của mRNA và protein gai?
Phần kế tiếp: Đánh giá báo cáo từ cơ quan y tế của Úc, Nhật Bản và Châu Âu sẽ cho thấy lý do chi tiết tại sao CDC rút lại tuyên bố rằng mRNA phân giải nhanh chóng và protein gai không tồn tại lâu trong cơ thể. Các báo cáo của Cơ quan Dược phẩm Châu Âu (EMA) sẽ cho thấy lớp vỏ LNP và mRNA di chuyển khắp cơ thể như thế nào.
Bài đăng trên The Epoch Times – Epoch Health của đồng tác giả: Allison Krug và Tiến sĩ Ram Duriseti, cùng sự tham gia của Tiến sĩ Lâm Hiểu Húc (Xiaoxu Sean Lin) và Tiến sĩ Đổng Vũ Hồng.
(Allison Krug: Allison Krug là một nhà dịch tễ học và một nhà quản lý dự án có kinh nghiệm thực hiện các chương trình y tế dân số. Cô là tác giả chính trong nghiên cứu phân tích rủi ro-lợi ích phân tầng đầu tiên của việc tiêm vaccine mRNA ở thanh thiếu niên và là biên tập viên cho hơn 400 bài báo nghiên cứu được xuất bản trên các tạp chí được bình duyệt và có hệ số tác động cao. Cô cũng là người sáng lập và giám đốc điều hành của Artemis Biomedical Communications, LLC.
Tiến sĩ Ram Duriseti: Tiến sĩ Duriseti là phó giáo sư lâm sàng và là bác sĩ – nhà khoa học tại Đại học Stanford. Ông nhận bằng bác sĩ tại Đại học Michigan, được đào tạo y khoa và nhận bằng tiến sĩ chuyên ngành Mô hình quyết định tính toán tại Đại học Stanford. Ông đã thực hành trong lĩnh vực y học cấp cứu lâm sàng tại cộng đồng và trong môi trường học thuật hơn 22 năm.
Tiến sĩ Lâm Hiểu Húc (Xiaoxu Sean Lin): Là giáo sư trợ tá tại Khoa Khoa học Y sinh tại Đại học Phi Thiên – Middletown New York. Tiến sĩ Lâm cũng là một nhà phân tích và bình luận thường xuyên cho Epoch Media Group, VOA và RFA. Tiến sĩ Lâm là một cựu chiến binh từng là nhà vi trùng học của Lục quân Hoa Kỳ. Tiến sĩ Lâm cũng là thành viên của Ủy ban Nguy cơ Hiện tại: Trung Quốc. Dr. Yuhong Dong, M.D., Ph.D.
Tiến sĩ Đổng Vũ Hồng: Bác sĩ y khoa và tiến sĩ, phụ trách chuyên mục Sức khỏe của The Epoch Times. Và là cựu chuyên gia khoa học y tế cao cấp và lãnh đạo cảnh giác dược tại Trụ sở chính của Novartis ở Thụy Sĩ. Bà đã từng đoạt giải thưởng Novartis trong bốn năm. Bà có kinh nghiệm nghiên cứu tiền lâm sàng về virus học, miễn dịch học, ung thư học, thần kinh học và nhãn khoa, đồng thời cũng có kinh nghiệm lâm sàng về bệnh truyền nhiễm và nội khoa. Bà lấy bằng bác sĩ và tiến sĩ về bệnh truyền nhiễm tại Đại học Bắc Kinh, Trung Quốc).
Theo The Epoch Times – Epoch Health tiếng Anh
Đức Nhân biên dịch
THÔNG TIN ĐẶC BIỆT – HƯỚNG ĐI MỞ RA KỶ NGUYÊN MỚI:
-
- ‘Ganjing World’ (Thế Giới Kiền Tịnh) – Một Công ty Công nghệ cao có trụ sở chính tại Middle Town, New York, ra mắt nền tảng tích hợp thông tin nghe nhìn trực tuyến thế hệ mới nhiều tính năng phong phú với công nghệ đám mây mới nhất.
- ‘Ganjing World’ cam kết trải nghiệm thoải mái và bảo mật, phục vụ tất cả những nhà sáng tạo nội dung, có thể trình chiếu đồng thời hàng triệu video và phục vụ hàng trăm triệu lượt xem. ‘Ganjing World’ đảm bảo an toàn và lợi nhuận cao.
- Nền tảng này không liên quan tới chính trị, không thiên vị và trung lập. ‘Ganjing World’ kiên quyết tránh xa các nội dung không phù hợp dựa trên bốn tiêu chí: “không bạo lực, không nội dung khiêu dâm, không tội phạm và không ma túy hoặc gây hại”.
- Sứ mệnh của ‘Ganjing World’ hướng đến “Truyền thông xã hội” và “Truyền thông cá nhân” thân thiện với mọi gia đình. Một nền tảng số rộng lớn cho phép mọi lứa tuổi tự do chia sẻ kiến thức, ý tưởng, quan điểm và giải trí về nhiều chủ đề… mà không sợ bị kiểm duyệt. ‘Ganjing World’ mang đến trải nghiệm phong phú và trong sạch.
- ‘Ganjing World’ (Thế Giới Kiền Tịnh) – Một Công ty Công nghệ cao có trụ sở chính tại Middle Town, New York, ra mắt nền tảng tích hợp thông tin nghe nhìn trực tuyến thế hệ mới nhiều tính năng phong phú với công nghệ đám mây mới nhất.
NTD Việt Nam